前体蛋白是无活性的,需要通过翻译后修饰(PTM)才能解锁繁多的蛋白类型和功能。翻译后修饰(PTM)是调节蛋白质功能的一种极其重要的机制.目前,已知在哺乳动物细胞蛋白中发现了600多种修饰。除了磷酸化、糖基化、乙酰化、泛素化和甲基化等经典的PTMs外,越来越多的新的修饰被发现,如琥珀酰化、羟丁基化和乳酸酰化等,在人类癌症的治疗和预防方面的应用前景有待进一步探索。
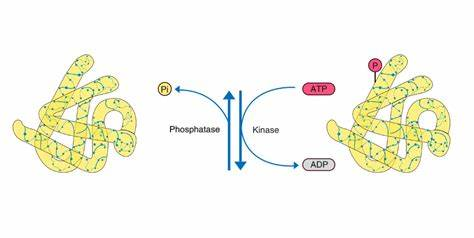
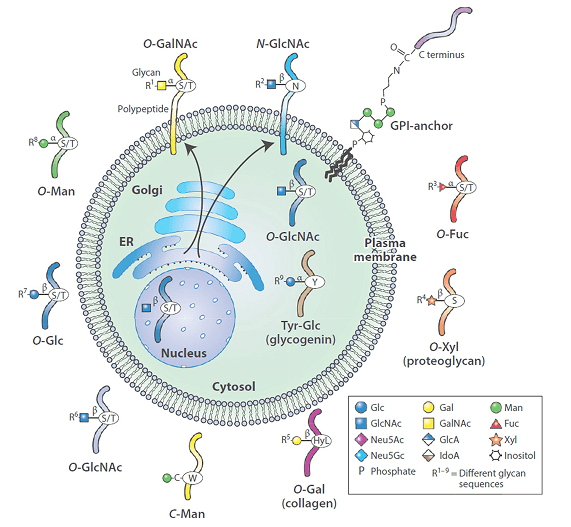
磷酸化修饰是可逆的,主要发生在丝氨酸、苏氨酸或酪氨酸残基,是目前研究最深入的翻译后修饰之一。哺乳动物细胞中约30%的蛋白质在一个或多个位点被磷酸化,不适当的蛋白质磷酸化是许多人类疾病的原因。糖基化是多种生物环境中普遍存在的PTM,对蛋白质的折叠、构象、分布、稳定性和活性都有重要影响。哺乳动物的糖基化主要有两种类型,以天冬氨酸连接(N-连接)或丝氨酸/苏氨酸连接(O-连接)寡糖形式存在的碳水化合物是许多细胞表面和分泌蛋白的主要结构成分。蛋白质糖基化的改变可以改变蛋白质的构象、寡聚和转换,从而导致细胞信号通路的改变。
下图展示的是细胞膜和分泌蛋白的糖基化
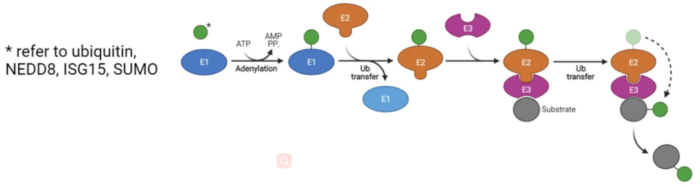
泛素是一类分子量为 8 kDa 的多肽。泛素化是指泛素激活酶(e1)、泛素结合酶(e2)和泛素连接酶(e3)的酶级联作用下,泛素(Ub)分子附着在底物蛋白赖氨酸残基上,产生单泛素化、多泛素化和支化泛素化三种主要类型。这是由去泛素化酶(DUBs)反向调节的。除了泛素化,还有一些泛素样分子,包括SUMO、NEDD8、ISG15、FAT10、ATGs、HUB1和FUB1,它们通过与泛素类似的酶联反应结合到它们的底物上。在乙酰基转移酶或非酶的催化下,将乙酰基团转移并添加到蛋白赖氨酸残基或蛋白N端上的过程。乙酰化修饰分为2类:蛋白N端的乙酰化修饰和蛋白赖氨酸的乙酰化修饰。80- 90% 的真核细胞蛋白是N-乙酰化,但其确切的生物学意义仍不清楚。
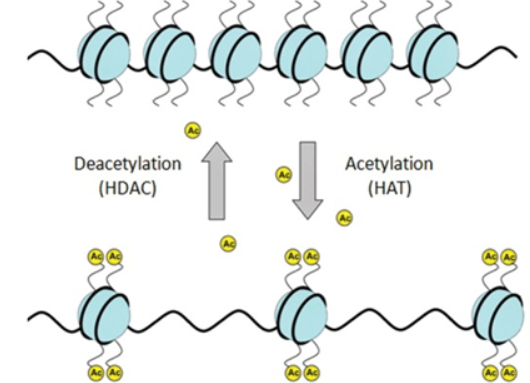
早期,乙酰化研究主要集中在细胞核内的组蛋白以及其对基因转录表达调控上。许多转录辅助活化因子都具有乙酰基转移酶内在活性,而转录辅助抑制因子则与去乙酰酶活性相关。后来,随着质谱技术的发展,发现在胞质或其他细胞器中大量的非组蛋白存在赖氨酸乙酰化修饰的现象。越来越多的非组蛋白的特定位点乙酰化已被证实可调节其活性、定位、特异性相互作用以及稳定性/降解。
乙酰化是一个普遍而重要的蛋白质翻译后修饰,不仅集中在对细胞染色体结构的影响以及对核内转录调控因子的激活方面,而且还影响参与细胞周期和新陈代谢、肌动蛋白聚合控制、肿瘤及多聚谷氨酰胺疾病等方方面面。蛋白质乙酰化也是近年来众多疾病新药开发设计的有利靶标。
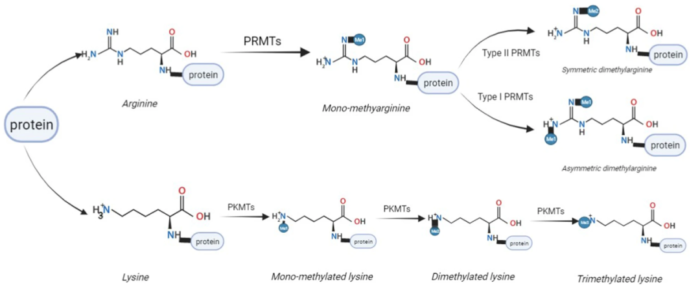
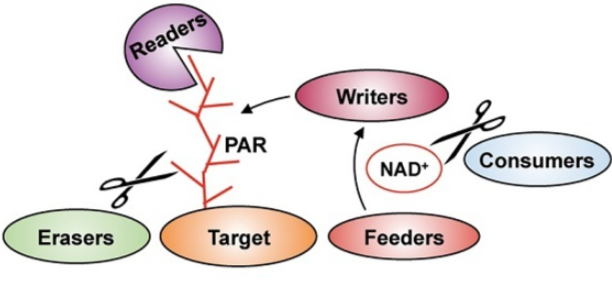
蛋白质的甲基化主要发生在赖氨酸或精氨酸残基上。赖氨酸可以被赖氨酸甲基转移酶(kmt)单甲基化、二甲基化或三甲基化,然后被赖氨酸去甲基化酶(kdm)去除。精氨酸可以被蛋白精氨酸甲基转移酶(PRMTs)单甲基化,也可以被不对称或对称二甲基化,这可以被精氨酸去甲基化酶(RMDs)逆转。蛋白质甲基化经常与乙酰化并列,因为它们都是常见的表观遗传修饰,经常发生在组蛋白上。除组蛋白外,很多种蛋白都能发生甲基化。蛋白质甲基化可能影响蛋白质-蛋白质相互作用,蛋白质-DNA或蛋白质-RNA相互作用,蛋白质稳定性,亚细胞定位或酶活性。许多转录因子的甲基化修饰可以影响基因表达。ADP核糖基化是一种高度保守的PTM,涉及在靶蛋白上添加一个或多个ADP核糖,分为单ADP核糖基化或多ADP核糖基化,也称为MARylation或PARylation。ADP-核糖化是一种动态可逆的PTM(翻译后修饰)系统,借用表观遗传调控中常用的说法,有一套writer、reader、eraser等酶系进行调控。writer即催化形成ADP-核糖化修饰的酶,统称为ADP-核糖基转移酶(ADP-ribosyl transferase,ADPRT或ART),是一类具有单或多ADP-核糖基转移活性的蛋白质。ADP核糖基化可以改变蛋白质的活性、稳定性和配体结合能力,对细胞功能产生重大影响。细菌利用单-ADP核糖化防御病毒侵染,也用来对抗宿主免疫系统,甚至作为细菌毒素攻击真核宿主细胞关键分子,在细胞中产生灾难性的后果。